Conceptos clave

La enorme posibilidad que tienen los átomos de combinarse entre sí es la causa de la gran diversidad de sustancias que existe en la naturaleza. Los átomos pueden presentarse en la materia aislados (gases nobles) o unidos a otros átomos iguales para dar lugar a elementos o unidos a átomos distintos para formar compuestos.Tanto los elementos como los compuestos pueden hallarse en la naturaleza en forma de moléculas o cristales.
¿Qué distingue la ensalada de pasta y la gasolina si tienen los mismos átomos?
En el siguiente vídeo encontramos la respuesta.
Si entras en la primera parte recordarás la clasificación de la materia macroscópica.
Las agrupaciones de átomos
Las propiedades químicas de los átomos depende de los electrones de su capa de valencia, según el número de electrones que tiene un átomo en esta capa no se combinan, se combinan compartiendo electrones entre átomos iguales o distintos o se combinan formando iones.
Una representación que nos informa del número de electrones de la última capa es:
La representación de Lewis de átomos
Se escribe el símbolo del elemento y se rodea de tantos puntos como electrones tiene en la última capa. El grupo de los elementos en la tabla se relaciona con el número de electrones de la capa de valencia.

Fuente:http://elfisicoloco.blogspot.com.es/2012/11/estructuras-de-lewis.html
LAS MOLÉCULAS
Las moléculas son agrupaciones de un número reducido de átomos.
La representación de Lewis de moléculas
Se escriben los símbolos de los átomos, se rodean tantos puntos como de electrones sin compartir y entre los átomos se representan por guiones los pares de electrones compartidos.
- Si los átomos son iguales, la distribución de los electrones es la misma entre los átomos unidos, son moléculas con uniones apolares.
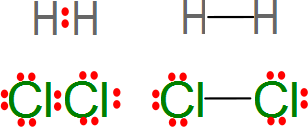
Fuente:http://2.bp.blogspot.com/-q9UwB1MP2eM/T8EEzNmENZI/AAAAAAAABnI/uM8AOVHPSec/s320/Lewis,+enlace+covalente.png
- Si los átomos son distintos, la distribución de los electrones es distinta entre los átomos unidos, son moléculas con uniones polares.

Fuente: http://hyperphysics.phy-astr.gsu.edu/hbasees/chemical/lewis.html
Distingue entre las moléculas de elementos y las de compuestos, desplázalas a la caja correcta.
LOS CRISTALES
Los cristales son agrupaciones de un gran número de átomos ordenados en las tres dimensiones en forma de red.
Según el carácter del elemento o elementos que se combinan forman diferentes tipos de cristales.
Cristales atómicos: En los nudos de la red hay átomos todos iguales.
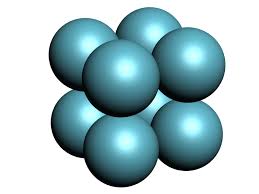
Fuente:http://www.esi2.us.es/IMM2/estructuras_cristalinas/estructura_cristalina2.html
Cristales moleculares: En los nudos de la red hay átomos distintos en una determinada proporción.
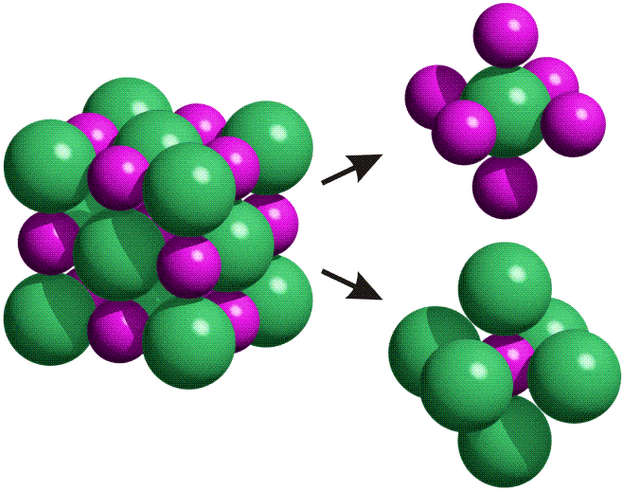
Fuente: http://www.quimitube.com/videos/fundamentos-del-enlace-ionico-y-tipos-de-redes-cristalinas
Cristales metálicos: En los nudos de la red hay cationes del metal y en los huecos están libres los electrones de valencia.
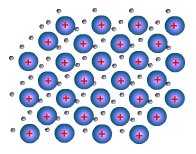
Fuente: http://www.portaleso.com/usuarios/Toni/electricidad_1eso/electricidad_1eso_indice.html
Cristales iónicos: En los nudos de la red hay cationes y aniones alternados en una determinada proporción.

Fuente: http://www.darwin-milenium.com/estudiante/Fisica/Temario/Tema8.htm
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 3.0