Cristales
Cristales atómicos no metálicos
Red de átomos no metálicos iguales.
Ejemplos de cristales no metálicos: formas alotrópicas del carbono
El átomo de carbono se puede unir a otros formando estructuras distintas que se llaman formas alotrópicas y tienen propiedades diferentes.
Diamante: Red de átomos de carbono (C), cada átomo se une a otros cuatro, se forman redes tetraédricas.
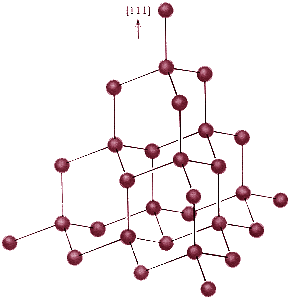
Fuente: http://2.bp.blogspot.com/-Uux2ChR3fbw/TbcLFtUpI2I/AAAAAAAAAAc/af7gWfYkCKk/s1600/diamante.gif
Grafito: Red de átomos de carbono (C), cada átomo se une a otros tres y queda libre un electrón, se forman capas hexagonales y entre capas hay débiles interacciones.
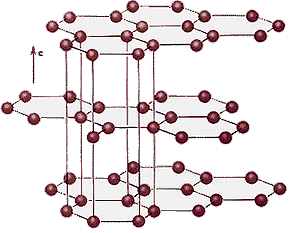
Fuente: http://4.bp.blogspot.com/-9iL0sxKLZHY/TmKDaepH-5I/AAAAAAAAAPk/_N3qPnB5Now/s1600/grafito.gif
Otras formas alotrópicas que no son cristales:
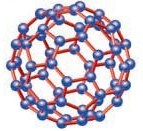
Fullereno: es la tercera forma molecular más estable del carbono, tras el grafito y el diamante. Es una molécula poliatómica (C60).
Grafeno y nanotubos de carbono: son nanomateriales, una dimensión tiene el tamaño de un átomo.
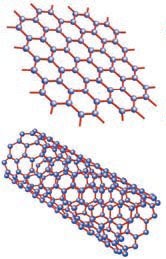
Fuente:http://2.bp.blogspot.com/_IP-xhn2P2rQ/SzwWvxS0-fI/AAAAAAAADYY/FCto3zJUVds/s400/5.jpg
Cristales metálicos
Red de cationes en un mar de electrones. Más de 80 elementos de la tabla son metales, todos ellos presentan este tipo de estructura.
La red de cualquier metal (M) está formada por un catión metálico, es un átomo que ha perdido electornes de valencia y por un mar o nube de electrones, son los electrones de valencia libres que están por los huecos de la red:

Fuente:https://sites.google.com/site/279enlaces/4-1/5-1-caracteristicas-y-propiedades
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 3.0