Moléculas
Moléculas elementales
En las moléculas de las sustancias simples se unen átomos de elementos no metálicos iguales. Los átomos comparten electrones hasta completar la capa de valencia (regla del octeto). Al ser átomos iguales la distribución de electrones es la misma, forman moléculas apolares.
Moléculas diatómicas
Comparten pares de electrones entre dos átomos. La forma de las moléculas es lineal.
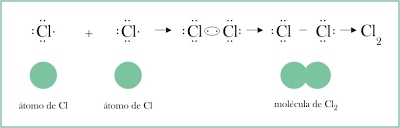
1. Molécula de cloro: Cada átomo de cloro comparte un electrón con el otro átomo para completar la capa de valencia, en la molécula se comparten un par de electrones. Se forma un enlace simple.
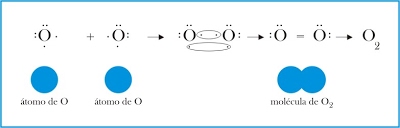
2. Molécula de oxígeno: Cada átomo de oxígeno comparte dos electrones con el otro átomo para completar la capa de valencia, en la molécula se comparten dos pares de electrones. Se foma un doble enlace.
3. Molécula de nitrógeno: Cada átomo de nitrógeno comparte tres electrones con el otro átomo para completar la capa de valencia, en la molécula se comparten tres pares de electrones.Se foma un triple enlace

Fuente: https://sites.google.com/site/279enlaces/enlaces-covalentes/tipos-de-enlace-covalentes
Moléculas poliatómicas
Comparten pares de electrones entre varios átomos.
Ozono: Se comparten pares de electrones entre 3 átomos de oxígeno. Su forma es angular.
O3

Fuente:http://pagina.jccm.es/medioambiente/rvca/calidad/imgcalidad/o3.jpg
Molécula de fósforo:Se comparten pares de electrones entre 4 átomos de fósforo. Su forma es tetraédrica.
P4
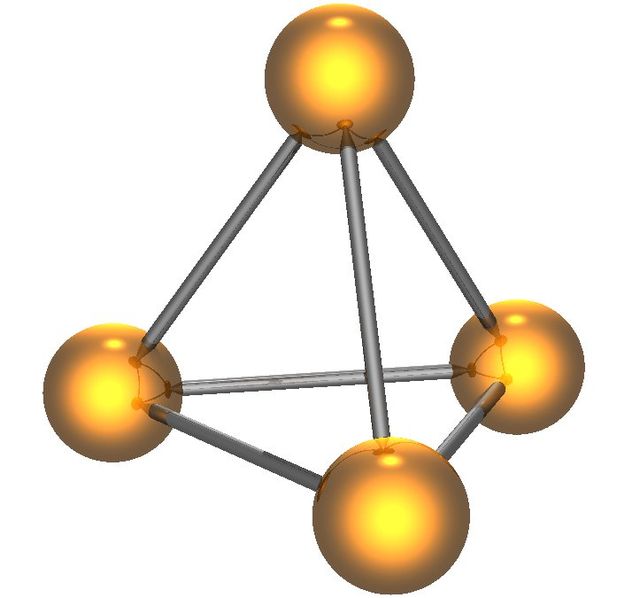
Fuente:http://es.wikipedia.org/wiki/F%C3%B3sforo#mediaviewer/Archivo:White_phosphrous_molecule.jpg
Molécula de azufre:Se comparten pares de electrones entre 8 átomos de azufre. Su forma es un anillo octogonal silla.
S8
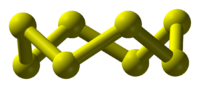
Fuente:http://upload.wikimedia.org/wikipedia/commons/thumb/2/22/Cyclooctasulfur-gate-3D-balls.png/200px-Cyclooctasulfur-gate-3D-balls.png
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 3.0